Articles
- Page Path
- HOME > Res Vestib Sci > Volume 20(2); 2021 > Article
-
Review
전정질환에서 유전학 연구의 최신 지견 -
최재환

- Update on Genetic Study of Vestibular Disorder
-
Jae-Hwan Choi

-
Research in Vestibular Science 2021;20(2):37-44.
DOI: https://doi.org/10.21790/rvs.2021.20.2.37
Published online: June 14, 2021
Department of Neurology, Pusan National University School of Medicine, Research Institute for Convergence of Biomedical Science and Technology, Pusan National University Yangsan Hospital, Yangsan, Korea
- *Corresponding Author: Jae-Hwan Choi Department of Neurology, Pusan National University Yangsan Hospital, Pusan National University School of Medicine, 20 Geumo-ro, Mulgeum-eup, Yangsan 50612, Korea Tel: +82-55-360-2122 Fax: +82-55-360-2152 E-mail: rachelbolan@hanmail.net
• Received: June 1, 2021 • Revised: June 5, 2021 • Accepted: June 7, 2021
Copyright © 2021 by The Korean Balance Society. All rights reserved.
This is an Open Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/4.0) which permits unrestricted non-Commercial use, distribution, and re-production in any medium, provided the original work is properly cited.
- 3,403 Views
- 95 Download
Abstract
- The wide availability of next-generation sequencing has enabled a rapid progress in the discovery of genetic variants associated with many disorders. However, the contribution of genetic factors in vestibular disorders is largely unknown due to the low prevalence of familial disorders and the clinical diversity. A detailed clinical characterization of patients and a choice of proper genetic tests are required to identify the genetic contribution in vestibular disorders. In this review, we will introduce a genetic approach for vestibular disorders and update the evidences to support the genetic contribution in vestibular disorders.
서 론
전정질환에서 유전학적 접근방법
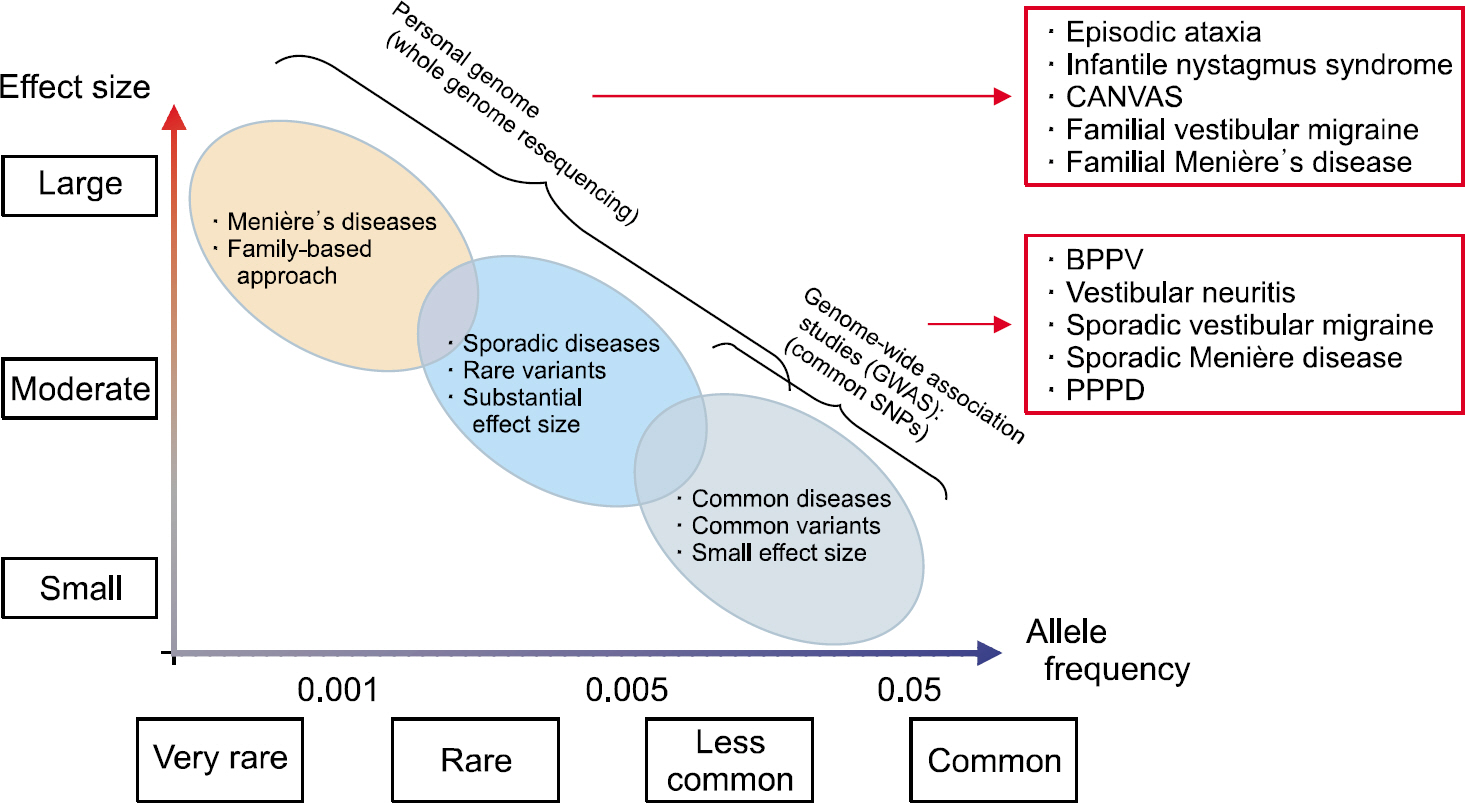
Fig. 1.Application of genetic study for vestibular disorders according to allele frequencies and effect sizes. CANVAS, cerebellar ataxia with neuropathy and vestibular areflexia syndrome; BPPV, benign paroxysmal positional vertigo; PPPD, persistent postural-perceptual dizziness; SNP, single nucleotide polymorphism.
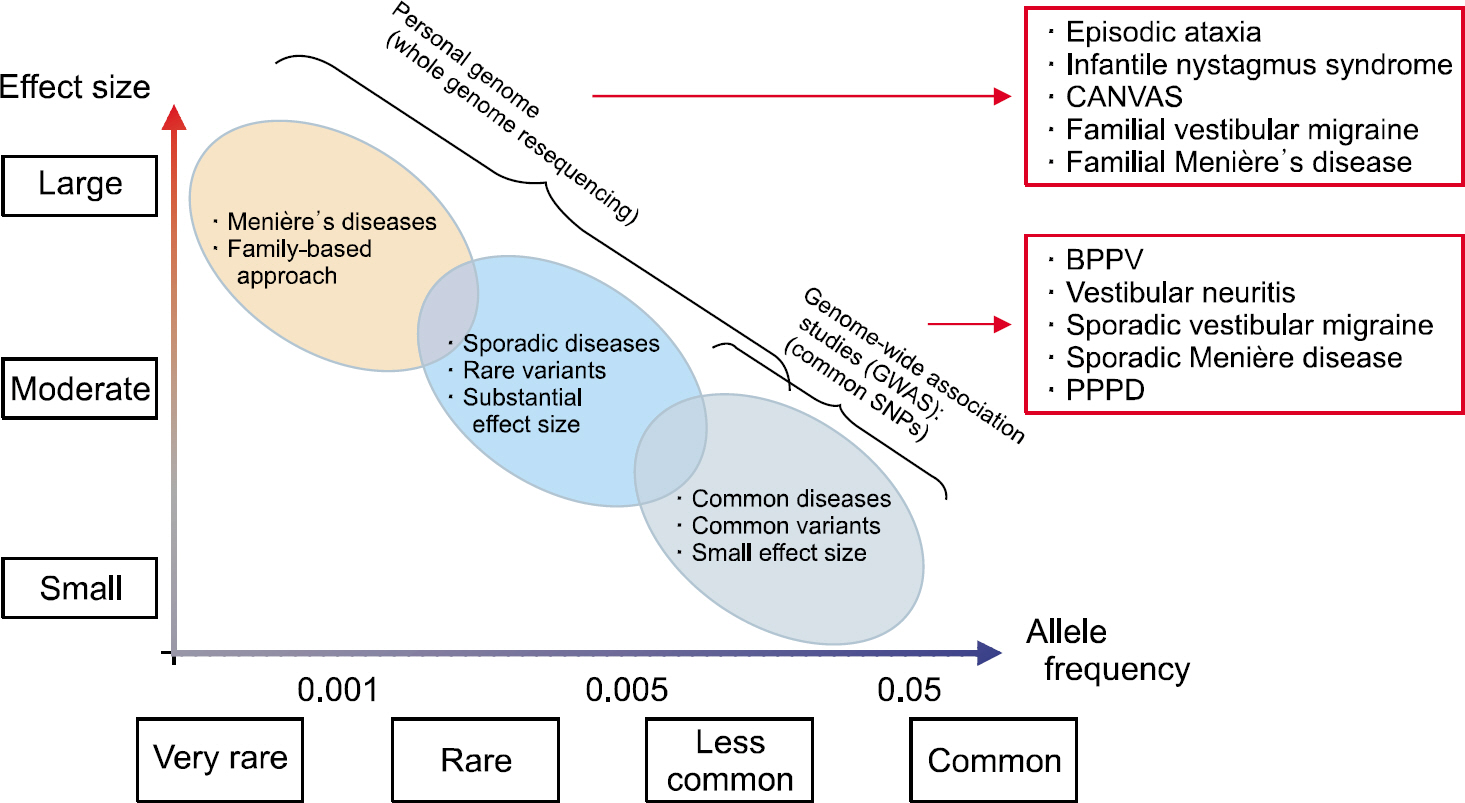

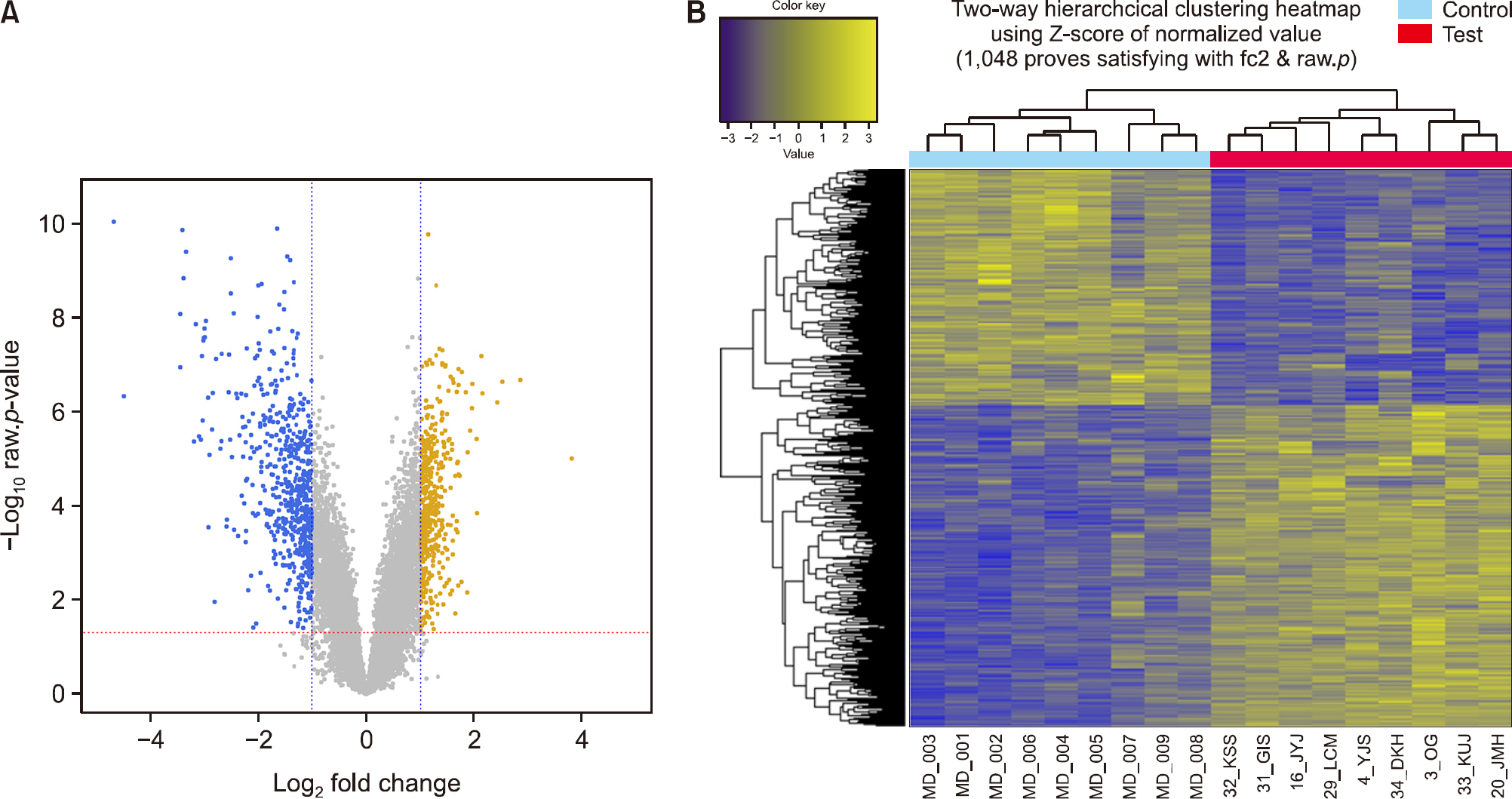
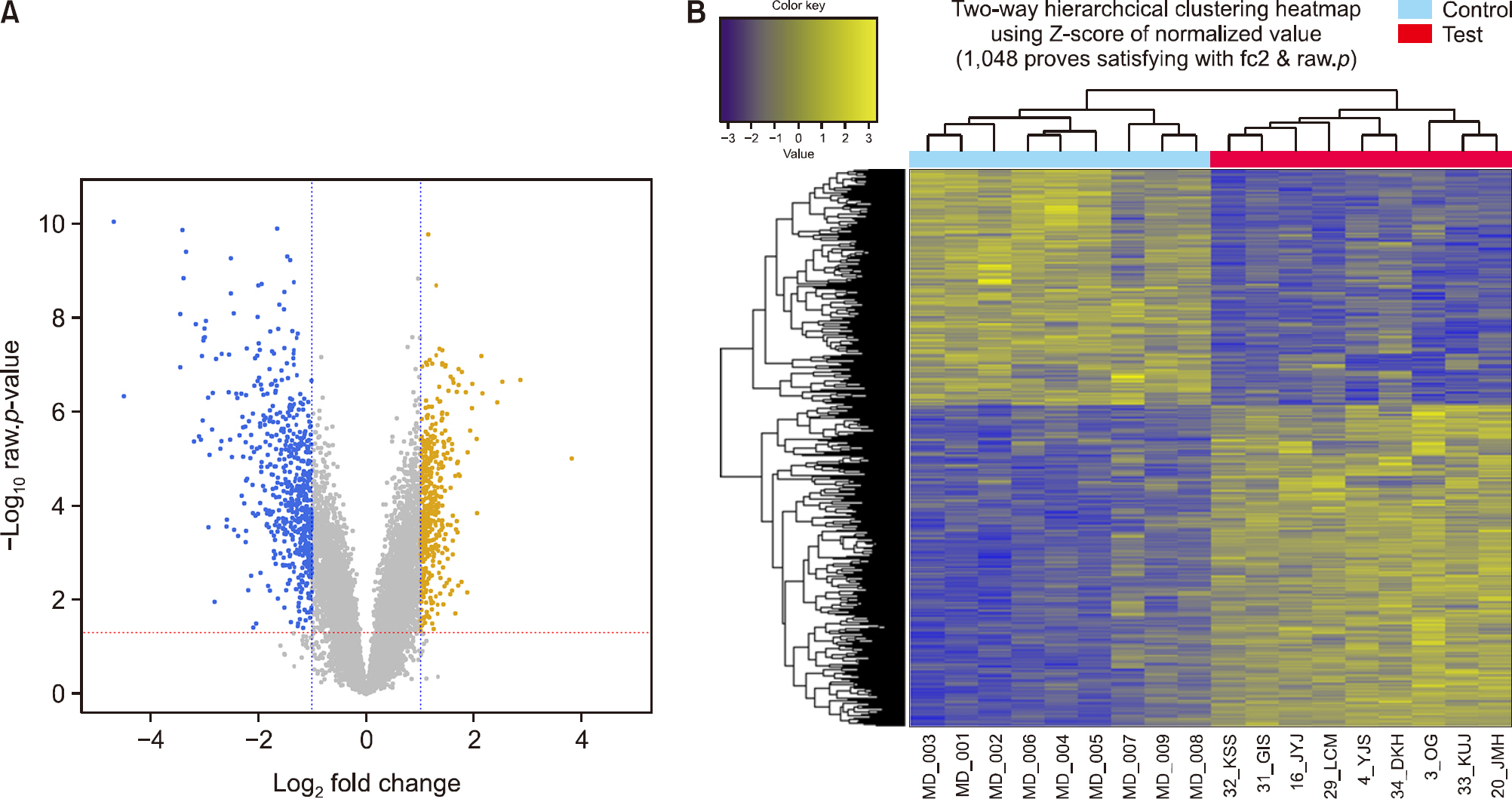
Fig. 2.Gene expression profiling. (A) Volcano plot of differentially expressed genes (DEGs) between disease (test) and control groups. Yellow and blue points represent up-regulated and down-regulated DEGs, respectively. The x-axis shows the fold changes in gene expression between two groups, and the y-axis shows the statistical significance of the differences. (B) Results of a hierarchial clustering analysis of up-regulated and down-regulated DEGs in disease group compared to control groups. Each group includes nine individuals and each column represents one individual's sample. Yellow and blue colors indicate high and low relative expression, respectively.

전정질환에서 유전학 연구의 최근 동향(Table 1)
Table 1.Genetic studies reported in vestibular disorders since 2016
| Study design | Methods | Gene or locus | Gene function or main results | Reference |
|---|---|---|---|---|
| Cerebellar ataxia with neuropathy and vestibular areflexia syndrome | ||||
| Familial | Multi-step PCR | RFC1 | Biallelic intronic AAGGG or ACAGG repeat expansion Involved in DNA repair | [10–18] |
| Vestibular neuritis | ||||
| Case-control | Association study (GWAS) | NR3C2, ANKRD30A, MED30 | Involved in viral process | [19] |
| LMX1A, SLC30A8 | Involved in insulin metabolism | [19] | ||
| Case-control | Gene expression profiling | CLEC12A, SLC2A3, MGAM, SLC04C1, CLEC4D, et al. | Up-regulation of genes associated with neutrophil-mediated immune response in vestibular neuritis | [6] |
| Vestibular migraine | ||||
| Familial | Linkage analysis | 9q13-q22 | Chromosome locus associated with vestibular migraine | [22] |
| Familial | NGS | TRPM7 | Alteration in intracellular Ca2+ and Mg2+ homeostasis | [25] |
| Case-control | Association study | 5-HTR6 | Release of substrate P and calcitonin gene-related peptides | [30] |
| Case-control | Gene expression profiling | RPS14, RPL17, RPS27A, RPS21, FAU, RPL23, RPL35, et al. | Down-regulation of genes related to the ribosome pathway | [7] |
| Menière's disease | ||||
| Familial | NGS | FAM136A, DTNA, PRKCB, DPT, SEMA3D | Involved in the formation of inner ear structures | [1] |
| Case-control | NGS | GJB2, USH1G, SLC26A4, ESRRB, CLDN14, MARVELD2 | Excess of rare variants in hearing loss genes | [31] |
| Case-control | NGS | NTN4 | Enrichment of damaging missense variants in genes related with axonal guidance signaling | [32] |
| Case-control | NGS | FAM136A, DTNA, DPT, PTPN22, NFKB1, CXCL10, TLR2, MTHFR, SLC44A2, NOS3, NOTCH2 | Multiple genetic predispositions in the development of Menière's disease | [33] |
| Case-control | NGS | OTOG | Burden of rare variants in OTOG gene in familial Menière's disease | [34] |
| Case-control | Gene expression profiling | GSTM1, TMEM176A, TMEM176B SLC4A1, SLC4A10 | Up-regulation of immune-related genes | [8] |
| Down-regulation of genes related to ion homeostasis | [8] | |||
| Case-control | Gene expression profiling | 1L-1β, CCL3, CCL22, CXCL1 | Significant differences of cytokine/chemokines between Menière's disease and vestibular migraine | [9] |
| BPPV | ||||
| Familial | Linkage analysis | Chromosome 15 | Chromosome locus associated with BPPV | [35] |
| Case-control | Association study | LOXL1 | Involved in the dysfunction of elastogenesis | [36] |
| Case-control | Association study | CACNA1A | Association between calcium channel function and the development of BPPV | [37] |
| Familial | NGS | PCDHGA10 | Involved in otoconia formation | [38] |
| PPPD | ||||
| Case-control | Association study | DRD2 | Reduction in the number of dopamine receptor D2 molecules in the brain | [39] |
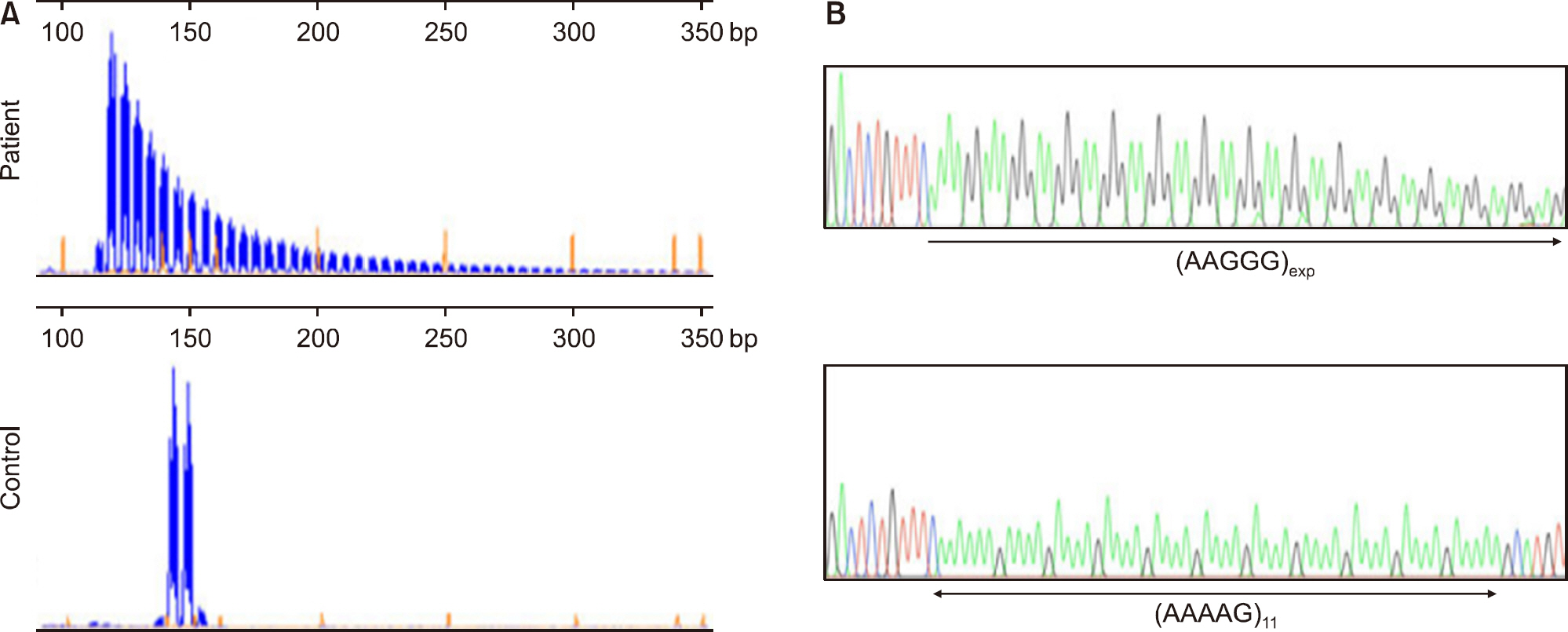
Fig. 3.Biallelic expansion of a mutated AAGGG repeated unit in intron 2 of RFC1 causing cerebellar ataxia with neuropathy and vestibular areflexia syndrome and late-onset ataxia. (A) Repeat-primed polymerase chain reaction (PCR) targeting the mutated AAGGG repeated unit. The representative plots from a patient carrying the AAGGG repeat expansion and one non-carrier are shown. (B) Sanger sequencing of long-range PCR reactions confirms the AAAAG to AAGGG nucleotide change of the repeated unit in patients. Adapted from the article of Cortese et al. [10] according to the Creative Commons License.


결 론
Acknowledgments
- 1. Roman-Naranjo P, Gallego-Martinez A, Lopez Escamez JA. Genetics of vestibular syndromes. Curr Opin Neurol 2018;31:105–10.ArticlePubMed
- 2. Gallego-Martinez A, Espinosa-Sanchez JM, Lopez-Escamez JA. Genetic contribution to vestibular diseases. J Neurol 2018;265(Suppl 1):29–34.ArticlePubMed
- 3. Yang Y, Muzny DM, Reid JG, Bainbridge MN, Willis A, Ward PA, et al. Clinical whole-exome sequencing for the diagnosis of mendelian disorders. N Engl J Med 2013;369:1502–11.ArticlePubMedPMC
- 4. Smith A, Farrah K. Gene expression profiling tests for breast cancer: a rapid qualitative review [Internet]. Ottawa (ON): Canadian Agency for Drugs and Technologies in Health; 2019.[cited Jun 7]. Available from: https://www.ncbi.nlm.nih.gov/books/NBK545134/.
- 5. Perez-Sanchez C, Barbarroja N, Messineo S, Ruiz-Limon P, Rodriguez-Ariza A, Jimenez-Gomez Y, et al. Gene profiling reveals specific molecular pathways in the pathogenesis of atherosclerosis and cardiovascular disease in antiphospholipid syndrome, systemic lupus erythematosus and antiphospholipid syndrome with lupus. Ann Rheum Dis 2015;74:1441–9.ArticlePubMed
- 6. Oh EH, Rhee JK, Shin JH, Cho JW, Kim DS, Park JY, et al. Neutrophil-mediated immune response as a possible mechanism of acute unilateral vestibulopathy. J Vestib Res 2020;30:363–74.ArticlePubMed
- 7. Oh EH, Shin JH, Cho JW, Choi SY, Choi KD, Rhee JK, et al. Episodic vestibular syndrome with hyperventilation-induced downbeat nystagmus. Cerebellum 2020 Oct 21;[Epub]. http://dx.doi.org/10.1007/s12311-020-01204-9.Article
- 8. Sun Y, Zhang D, Sun G, Lv Y, Li Y, Li X, et al. RNA-sequencing study of peripheral blood mononuclear cells in sporadic Ménière's disease patients: possible contribution of immunologic dysfunction to the development of this disorder. Clin Exp Immunol 2018;192:33–45.ArticlePubMed
- 9. Flook M, Frejo L, Gallego-Martinez A, Martin-Sanz E, Rossi-Izquierdo M, Amor-Dorado JC, et al. Differential proinflammatory signature in vestibular migraine and Meniere disease. Front Immunol 2019;10:1229. ArticlePubMedPMC
- 10. Cortese A, Simone R, Sullivan R, Vandrovcova J, Tariq H, Yau WY, et al. Biallelic expansion of an intronic repeat in RFC1 is a common cause of late-onset ataxia. Nat Genet 2019;51:649–58.ArticlePubMedPMC
- 11. Rafehi H, Szmulewicz DJ, Bennett MF, Sobreira NLM, Pope K, Smith KR, et al. Bioinformatics-based identification of expanded repeats: a non-reference intronic pentamer expansion in RFC1 causes CANVAS. Am J Hum Genet 2019;105:151–65.ArticlePubMedPMC
- 12. Gisatulin M, Dobricic V, Zühlke C, Hellenbroich Y, Tadic V, Münchau A, et al. Clinical spectrum of the pentanucleotide repeat expansion in the RFC1 gene in ataxia syndromes. Neurology 2020;95:e2912–23.ArticlePubMed
- 13. Akçimen F, Ross JP, Bourassa CV, Liao C, Rochefort D, Gama MTD, et al. Investigation of the RFC1 repeat expansion in a canadian and a brazilian ataxia cohort: identification of novel conformations. Front Genet 2019;10:1219. ArticlePubMedPMC
- 14. Aboud Syriani D, Wong D, Andani S, De Gusmao CM, Mao Y, Sanyoura M, et al. Prevalence of RFC1-mediated spinocerebellar ataxia in a North American ataxia cohort. Neurol Genet 2020;6:e440. ArticlePubMedPMC
- 15. Tsuchiya M, Nan H, Koh K, Ichinose Y, Gao L, Shimozono K, et al. RFC1 repeat expansion in Japanese patients with late-onset cerebellar ataxia. J Hum Genet 2020;65:1143–7.ArticlePubMed
- 16. Wan L, Chen Z, Wan N, Liu M, Xue J, Chen H, et al. Biallelic intronic AAGGG expansion of RFC1 is related to multiple system atrophy. Ann Neurol 2020;88:1132–43.ArticlePubMed
- 17. Scriba CK, Beecroft SJ, Clayton JS, Cortese A, Sullivan R, Yau WY, et al. A novel RFC1 repeat motif (ACAGG) in two Asia-Pacific CANVAS families. Brain 2020;143:2904–10.ArticlePubMedPMC
- 18. Currò R, Salvalaggio A, Tozza S, Gemelli C, Dominik N, Galassi Deforie V, et al. RFC1 expansions are a common cause of idiopathic sensory neuropathy. Brain 2021 May 9;[Epub]. http://dx.doi.org/10.1093/brain/awab072.Article
- 19. Rujescu D, Hartmann AM, Giegling I, Konte B, Herrling M, Himmelein S, et al. Genome-wide association study in vestibular neuritis: involvement of the host factor for HSV-1 replication. Front Neurol 2018;9:591. ArticlePubMedPMC
- 20. Greco A, Macri GF, Gallo A, Fusconi M, De Virgilio A, Pagliuca G, et al. Is vestibular neuritis an immune related vestibular neuropathy inducing vertigo? J Immunol Res 2014;2014:459048. ArticlePubMedPMC
- 21. Bahmad F Jr, DePalma SR, Merchant SN, Bezerra RL, Oliveira CA, Seidman CE, et al. Locus for familial migrainous vertigo disease maps to chromosome 5q35. Ann Otol Rhinol Laryngol 2009;118:670–6.ArticlePubMedPMC
- 22. Peddareddygari LR, Kramer PD, Hanna PA, Levenstien MA, Grewal RP. Genetic analysis of a large family with migraine, vertigo, and motion sickness. Can J Neurol Sci 2019;46:512–7.ArticlePubMed
- 23. Lee H, Jen JC, Cha YH, Nelson SF, Baloh RW. Phenotypic and genetic analysis of a large family with migraine-associated vertigo. Headache 2008;48:1460–7.ArticlePubMed
- 24. Lee H, Jen JC, Wang H, Chen Z, Mamsa H, Sabatti C, et al. A genome-wide linkage scan of familial benign recurrent vertigo: linkage to 22q12 with evidence of heterogeneity. Hum Mol Genet 2006;15:251–8.ArticlePubMed
- 25. Oh EH, Shin JH, Cho JW, Choi SY, Choi KD, Choi JH. TRPM7 as a candidate gene for vestibular migraine. Front Neurol 2020;11:595042. ArticlePubMedPMC
- 26. Ryazanova LV, Rondon LJ, Zierler S, Hu Z, Galli J, Yamaguchi TP, et al. TRPM7 is essential for Mg(2+) homeostasis in mammals. Nat Commun 2010;1:109. ArticlePubMed
- 27. Carreño O, Corominas R, Fernández-Morales J, Camiña M, Sobrido MJ, Fernández-Fernández JM, et al. SNP variants within the vanilloid TRPV1 and TRPV3 receptor genes are associated with migraine in the Spanish population. Am J Med Genet B Neuropsychiatr Genet 2012;159B:94–103.ArticlePubMedPDF
- 28. Key FM, Abdul-Aziz MA, Mundry R, Peter BM, Sekar A, D'Amato M, et al. Human local adaptation of the TRPM8 cold receptor along a latitudinal cline. PLoS Genet 2018;14:e1007298. ArticlePubMedPMC
- 29. Chen SP, Fuh JL, Chung MY, Lin YC, Liao YC, Wang YF, et al. Genome-wide association study identifies novel susceptibility loci for migraine in Han Chinese resided in Taiwan. Cephalalgia 2018;38:466–75.ArticlePubMed
- 30. Wu X, Qiu F, Wang Z, Liu B, Qi X. Correlation of 5-HTR6 gene polymorphism with vestibular migraine. J Clin Lab Anal 2020;34:e23042. ArticlePubMed
- 31. Gallego-Martinez A, Requena T, Roman-Naranjo P, Lopez-Escamez JA. Excess of rare missense variants in hearing loss genes in sporadic meniere disease. Front Genet 2019;10:76. ArticlePubMedPMC
- 32. Gallego-Martinez A, Requena T, Roman-Naranjo P, May P, Lopez-Escamez JA. Enrichment of damaging missense variants in genes related with axonal guidance signalling in sporadic Meniere's disease. J Med Genet 2020;57:82–8.ArticlePubMed
- 33. Oh EH, Shin JH, Kim HS, Cho JW, Choi SY, Choi KD, et al. Rare variants of putative candidate genes associated with sporadic Meniere's disease in East Asian population. Front Neurol 2020;10:1424. ArticlePubMedPMC
- 34. Roman-Naranjo P, Gallego-Martinez A, Soto-Varela A, Aran I, Moleon MDC, Espinosa-Sanchez JM, et al. Burden of rare variants in the OTOG gene in familial Meniere's disease. Ear Hear 2020;41:1598–605.ArticlePubMed
- 35. Gizzi MS, Peddareddygari LR, Grewal RP. A familial form of benign paroxysmal positional vertigo maps to chromosome 15. Int J Neurosci 2015;125:593–6.ArticlePubMed
- 36. Deng M, Liu C, Jiang W, Wang F, Zhou J, Wang D, et al. A novel genetic variant associated with benign paroxysmal positional vertigo within the LOXL1. Mol Genet Genomic Med 2020;8:e1469. ArticlePubMedPMCPDF
- 37. Pan R, Qi X, Wang F, Chong Y, Li X, Chen Q. Correlations of calcium voltage-gated channel subunit alpha1 A (CACNA1A) gene polymorphisms with benign paroxysmal positional vertigo. Med Sci Monit. 2019 Feb 2;25:946–51.Article
- 38. Xu Y, Zhang Y, Lopez IA, Hilbers J, Griswold AJ, Ishiyama A, et al. Identification of a genetic variant underlying familial cases of recurrent benign paroxysmal positional vertigo. PLoS One 2021;16:e0251386. ArticlePubMedPMC
- 39. Cui L, Yan Z, Gong L, Tang J, Kong M, Sun F, et al. Association between dopamine receptor D2 Taq IA gene polymorphism and persistent postural-perceptual dizziness. J Vestib Res 2019;29:131–6.ArticlePubMedPMC
REFERENCES
Figure & Data
References
Citations
Citations to this article as recorded by 


 KBS
KBS
 PubReader
PubReader ePub Link
ePub Link Cite
Cite