완전 혹은 분지성 전정신경염 환자에서 심혈관계위험인자의 빈도
Cardiovascular Risk Factors in Total or Divisional Vestibular Neuritis
Article information
Trans Abstract
Objectives
In vestibular neuritis (VN), the lesion preferentially affects the superior vestibular nerve because of the anatomic arrangement. It is well known that VN patients have a higher score of metabolic syndrome or a higher incidence of vertebral artery hypoplasia than controls. However, it is unclear whether the frequency of cardiovascular risk factors can affect the selective involvement of the branch of the vestibular nerve. Thus, we investigated the influence of cardiovascular risk factors on the development of total- or divisional VN.
Methods
61 patients with VN were enrolled. Video head impulse tests and caloric tests were performed to determine which vestibular divisionswere affected. The patients were divided into divisional-VN (superior or inferior) and total-VN groups. Statistical analysis of the frequency of cardiovascular risk factors was performed only in superior and total VN groups because the number of inferior VN patients was too small to be statistically analyzed.
Results
Nineteen (31.1%) patients were classified as the total-VN group. In the divisional-VN group (42 patients, 65.6%), 40 were superior VN. The frequency of cardiovascular risk factors are not significantly different in superior VN and total-VN groups (All patients 50/61 [82.0%], superior-VN 36/40 [90.0%], total-VN 13/19 [68.4%]). The frequency of having more than one cardiovascular risk factor was slightly higher in the superior VN group, (13 [68.4%] vs. 36 [90.0%], p=0.062) but did not show any significant difference.
Conclusions
The number of cardiovascular risk factors did not differ in superior VN patients compared to total VN patients.
서 론
전정신경염(vestibular neuritis, VN)은 급성말초전정병의 대표적인 원인질환이다. 전정신경염의 대표적인 증상은 갑자기 발생한 지속적인 회전성 현훈, 오심과 구토, 자세불안정 등이 있다[1]. 급성기에 환자를 진찰하면 대개 건측을 향하는 수평회전성 안진과, 병측의 두부충동검사 이상, 자세불안정 및 병측을 향하는 가쪽쏠림을 관찰할 수 있다[2]. 온도안진검사에서 병측의 반고리관마비, 비디오두부충동검사에서 전정안구반사(vestibulo-ocular reflex, VOR)의 이득의 감소 및 따라잡기신속안구운동(catch up saccades)이 나타나고, 회전의자검사에서는 저주파에서 위상차선행(phase lead), 전정안구반사의 이득 감소 및 비대칭의 병측편위가 나타날 수 있다[3]. 진찰소견과 전정기능검사 소견을 종합하여 반고리관, 난형낭, 구형낭 중 어느 부위의 기능 저하가 있는지 확인 가능하며, 이를 통해 전정신경의 어느 분지가 이환되었는지 알 수 있다[4].
전정신경염은 상, 하 전정신경만 각각 침범하는 분지성전정신경염(divisional vestibular neuritis, divisional VN) 중상전정신경염(superior vestibular neuritis, superior VN)이 다수를 차지하고, 이어 모든 분지를 침범하는 완전 전정신경염(total vestibular neuritis, total VN)과 가장 적은 빈도의 하전정신경염(inferior VN)이 있다[4]. 이렇듯 전정신경염에서는 전정신경의 분지 중 상전정신경이 주로 이환되는 것으로 알려져 있는데, 이는 상전정신경의 주행경로가 하전정신경에 비해 길고 더 좁으며, 많은 골침(bony spicules)이 존재하여 허혈(ischemia) 및 신경 포착(nerve entrapment)에 보다 취약하기 때문이라고 추정된다[5].
전정신경염의 발생 기전으로 바이러스 감염 및 혈관 허혈이 제기되는데[2], 전정신경염 환자들은 정상인에 비해 대사증후군의 요소를 가지고 있는 빈도가 더 높았고[6], 현훈, 구역, 구토, 균형장애만을 보이는 고립전정증후군(isolated vestibular syndrome)이 있던 환자들을 추적 관찰한 결과 추후 허혈성 뇌경색이 발생할 위험이 3배 가량 높았다는 점은 전정신경염이 허혈성으로 발병 가능하다는 것을 시사하는 소견이다[7]. 반면, 부검소견 및 바이러스혈청검사 결과 등은 전정신경염이 바이러스 감염에 의해 발생 가능함을 시사한다[8]. 하지만 전정신경염의 침범분지에 따른 혈관성 위험인자나 염증성 원인에 대한 조사는 수행된 바 없다.
따라서, 본 연구에서는 종합적인 전정신경검사를 통해 전정신경염 환자를 분지성전정신경염과 완전 전정신경염군으로 분류하고 각 군에서 혈관성 위험 인자의 빈도를 조사하였다.
대상 및 방법
1. 대상
2014년 7월부터 2015년 12월까지 급성자 발현훈을 주소로 내원하여 신경학적 검사와 전정기능검사에서 전정신경염으로 진단되어 입원 치료한 환자를 대상으로 하였다. 본연구의 대상자는 (1) 발병 7일 이내의 24시간 이상 지속되는 급성 자발현훈을 호소하였고, (2) 청각 증상이 동반되지 않았으며, (3) 기타 신경학적 이상 소견이 동반되지 않고,(4) 정상 고막을 가지며 이과계 수술 기왕력이 없었으며,(5) 메니에르병이나 전정편두통 등 다른 전정질환으로 더잘 설명되지 않았다. 병력과 진찰 소견에서 중추성 현훈이 의심되는 경우 확산강조자기공명영상(diffusion-weighted magnetic resonance imaging)을 시행하여 중추성 원인이 없음을 확인하였다.
2. 심혈관계 위험 인자
의무기록에서 인구사회학적 특성 및 과거 병력, 흡연 유무, 지질검사를 포함한 혈액학적 검사 결과와 전정기능검사 결과를 수집하였다. 심혈관계위험인자를 평가하기 위해 고혈압, 당뇨, 이상지질혈증, 허혈성 심질환 및 허혈성뇌경색의 병력 유무와 체질량 지수(body mass index, BMI)를 함께 수집하였다. 대표적인 심혈관계위험인자인 프래밍험위험지수(Coronary heart disease risk score)에 흡연력, Total cholesterol 및 HDL cholesterol이 포함되어 있는 것을 고려하여 흡연력과 각각의 혈중지질농도를 함께 조사하였다. 또한, creatinine을 이용한 추정 사구체 여과율이 심혈관계질환 이환율 및 소혈관 질환(cerebral small vessel disease)에 관련성이 있다고 알려져 있어[9,10] 이를 함께 측정하였다.
고혈압의 병력은 환자가 과거에 고혈압을 진단 받아 항고혈압약제를 복용하고 있는 경우로 정의하였으며 당뇨의 병력은 혈당강하약물이나 인슐린을 투약하고 있는 경우 혹은 HbA1c≥6.5%인 경우로 정의하였다. 이상지질혈증은과거에 해당 질환을 진단받고 스타틴계 약물을 복용중인 경우로 정의하였다. 허혈성 심질환은 과거에 안정형 협심증이나 불안정협심증, 혹은 심근경색 등 급성관상동맥질환을 진단받은 경우로 한정하였으며, 허혈성 뇌경색은 환자가 과거에 국소 신경학적 이상을 동반하며 뇌영상검사에서 허혈성 뇌경색이 확인된 경우로 정의하였다. 흡연력의 유무는 과거 혹은 현재 흡연중인 경우로 정의하였다. 입원 후 시행하였던 실험실검사 중 8시간 이상의 공복 후 측정한 혈중지질농도(lipid profile)를 수집하였고 혈액검사결과를 바탕으로 modification of diet in renal disease (MDRD)공식을 이용하여 사구체 여과율을 계산하였다.
3. 전정기능검사
모든 대상자들은 입원 중 전정기능에 영향을 줄 수 있는 약제를 복용하지 않았다. 환자들은 발병 7일 이내에 입원후 한차례의 비디오안진검사, 온도안진검사, 안저사진촬영, 주관적시수직검사,경부 및 안구 전정유발근전위검사, 회전의자검사, 비디오두부충동검사를 시행하였다. 온도안진검사는 환자를 눕힌 후 30° 가량 머리를 세운 상태에서 섭씨 25°와 50°의 공기로 1분간 외이도에 온도 자극을 주었고, Jonkee 공식을 이용하여 반고리관 마비 정도를 계산하였다. 온도안진검사에서 병측 반고리관마비가 25% 이상으로 측정 된 경우 수평반고리관이 이환되었다고 분류하였다. 전정유발근전위검사는 헤드폰으로 1 kHz tone burst 음을 이용하여 자극하였고, 동측흉쇄유돌근에서 경부전정유발근전위를 검사하여 p13과 n23의 잠복기 및 진폭차 비를 측정하였으며 반대측 눈 아래에서 외안근전정유발근전위를 검사, n10의 역치 및 진폭차 비를 측정하였다. 주관적시수직검사는 암실에서 광원 막대가 수직에 위치하도록 환자가 양안으로 주시하며 조이스틱으로 조정, 5회 반복하여 평균을 내었으며 병측 방향이 다양하여 분석 시에는 각도의 절대값(°)을 이용하였다. 경부전정유발근전위검사에서 p13–n23파형의 진폭이 건측 보다 50% 이하로 감소하거나 외안근전정유발근전위검사에서 n10–p15파형의 진폭이 건측 보다 50% 이하로 감소된 경우 이상 소견으로 판단하였다. 회전의자검사는 System 2000 (Micromedical, Chatham, IL, USA)를 이용하여 0.01, 0.02, 0.08, 0.16, 0.32, 0.64 Hz의 정현파 검사(sinusoidal harmonic acceleration test, SHA test)에서 각각의 전정안구반사 이득을 측정하였다. 비디오두부충동검사는 ICS impulse 비디오고글(GN otometrics, Taastrup, Demark)을 착용하고 각 반고리관 당 약 30회의 회전 자극을 주었으며, 이득의 측정에 impulse goggle 구동 software인 OTOsuite Vestibular를 이용하였다. 비디오두부충동검사에서는 특정 반고리관을 자극하였을 때 따라잡기신속안구운동이 머리 움직임 중간에(covert saccades) 혹은 머리 움직임이후(overt saccades) 확인된 경우 혹은 전정안구반사 이득이 정상치 이하(수평반고리관 0.8, 전반고리관 및 후반고리관 0.7)로 떨어진 경우 해당 반고리관이 이환되었다고 판단하였다.
이를 종합하여, 임상적으로 전정신경염으로 진단되어 입원 치료한 총 66명의 환자 중 비디오두부충동검사 및 온도안진검사를 모두 시행한 61명만을 분석에 포함하였으며, 이 두 가지 검사결과를 토대로 상전정신경과 하전정신경의 이환 여부를 판단하였다. 상전정신경은 비디오두부충동검사에서 수평 및 전반고리관의 이상이 확인되거나 온도안진검사에서 25% 이상의 병측 반고리관마비가 있는 경우 이환되었다고 판단하였으며, 비디오두부충동검사에서 후반고리관의 이상이 있는 경우 하전정신경이 이환된 것으로 간주하였다. 상, 하전정신경 모두 기능이 저하되었을때 완전 전정신경염으로, 상, 하전정신경 각각의 분지만 침범하였을 때 분지성전정신경염으로 분류하였다. 총 61명중 19명이 완전 전정신경염, 40명이 상전정신경염(superior VN), 2명이 하전정신경염(Inferior VN)으로 분류되었다. 이중 표본수가 2명으로 적은 하전정신경염을 제외, 완전 전정신경염과 상전정신경염 환자를 대상으로 분석을 시행하였다.
4. 통계적 방법
통계적 분석은 PASW ver. 18 (SPSS Inc., Chicago, IL, USA)을 이용하여 상전정신경염과 완전 전정신경염군의 심혈관계위험인자들의 빈도와의 연관성을 chi-square test를 이용하여 교차분석으로 확인하였으며 체질량 지수 및 혈액검사 등의 연속변수는 t-test를 이용하였다. 전정기능검사의 결과에 대해 이분변수에는 chi-square test을, 연속변수의 비교에는 t-test를 사용하였다. p값이 0.05 미만일 때 통계적으로 유의한 것으로 판정하였다.
결 과
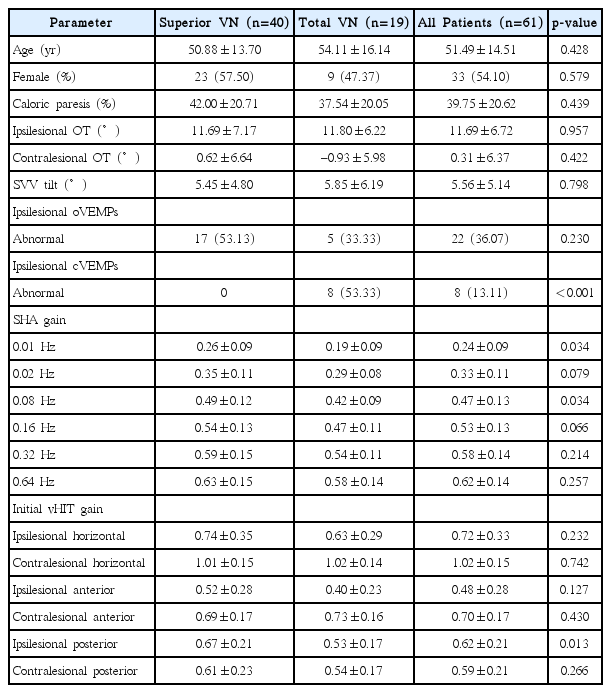
총 61명의 환자 중 19명(31.1%)이 완전 전정신경염군으로, 나머지 42명(68.9%)의 환자가 분지성전정신경염군으로 분류되었다. 분지성전정신경염 환자 중 40명(65.6%)은 상전정신경이, 나머지 2명(3.3%)은 하전정신경이 이환된 것으로 확인되었다. 전체 환자 중 33명(54.1%)가 남자였으며, 평균 연령은 51.5세였다. 분류 기준으로 사용되었던 온도안진검사와 비디오두부충동검사는 모든 환자에게서 시행되었으며, 추가적인 전정기능검사는 안저사진촬영 56명(91.8%), 주관적시수직검사 55명(90.2%), 경부 및 안구 전정유발근전위검사 49명(80.3%), 회전의자검사 57명(93.4%)에서 시행되었다. 상전정신경염군과 완전 전정신경염군에서 전정기능검사 결과를 비교하여 보았을 때(Table 1), 온도안진검사, 안구회선정도, 주관적시수직이상 및 외안근전정유발근전위검사 결과는 양 군 사이에서 통계적으로 유의한 차이를 보이지 않았다. 예상했던 바와 같이, 하전정신경의 기능을 반영하는 경부전정유발근전위검사 결과 완전전정신경염군에서 더 높은 빈도로 이상 소견이 관찰되었으며(p<0.001), 회전의자검사에서는 0.01 Hz와 0.08 Hz 등 저주파에서 완전 전정신경염군의 전정안구반사 이득이 더 낮게 측정되었다(p<0.05). 진단 기준으로 사용되었던 비디오두부충동검사에서는 동측후반고리관을 자극하였을 때 완전 전정신경염군에서 통계적으로 유의하게 더 낮은 이득을 보였다.
총 61명의 환자 중 50명(82.0%)이 고혈압, 당뇨, 이상지질혈증, 허혈성심질환, 허혈성뇌경색 및 흡연력 중 하나 이상의 심혈관계위험인자를 동반하였다. 하나 이상의 심혈관계위험인자를 지닌 환자는 완전 전정신경염군에서 13명(68.4%), 상전정신경염군에서 36명(90.0%)으로, 두 군에서 위험인자의 동반 빈도에는 유의한 차이가 없었으며 고혈압과 당뇨, 이상지질혈증 등 각 심혈관계위험인자의 빈도 또한 유사하였다. 총콜레스테롤(total cholesterol)을 제외한 입원 시 측정되었던 혈중지질농도 및 사구체여과율, 체질량 지수에서는 양 군의 차이는 없었다(Table 2). 총콜레스테롤은 완전 전정신경염군 보다 상전정신경염군에서 더 높게 측정되었다(187.75±24.37 vs. 162.74±40.26, p=0.036).
고 찰
전정신경염 환자 중 상전정신경염과 완전 전정신경염환자에게서 심혈관계위험인자를 조사해보니, 하나 이상의 심혈관계위험인자가 동반되는 비율 및 개별 위험인자의 유무의 차이는 관찰되지 않았다. 단, 전정신경염으로 입원당시 측정하였던 총콜레스테롤은 상전정신경염에서 완전전정신경염군 보다 높게 확인되었다. 또한 본 연구에서 관찰된 각 분지성전정신경염과 완전 전정신경염의 빈도는 기존 보고와 유사하였으며[4,11], 하전정신경만 침범한 경우(3.3%)도 기존 보고(1.3%–5%)와 비슷한 빈도로 관찰되었다[4,11,12].
각 전정기관은 다양한 전정기능검사를 통해 평가가 가능하다. 온도안진검사는 수평반고리관의 기능을, 비디오두부충동검사는 각 반고리관의 기능을 평가하며, 주관적시수직검사는 난형낭을, 경부 및 외안근전정유발근전위검사는 이석기관에서 기원한 전정신경의 기능을 각각 평가할 수 있어 이를 통해 전정신경염이 일부 신경 분지를 침범하였는지, 상하전정신경을 모두 침범하였는지 판단할 수 있다[4,13]. 전정신경은 상전정신경과 하전정신경으로 나뉘며, 상전정신경은 전반고리관, 수평반고리관 및 난형낭을 지배하고, 하전정신경은 후반고리관과 구형낭을 지배한다. 전정계의 혈액 공급은 미로동맥이 담당하는데, 앞전정동맥에서 난형낭, 전반고리관 및 수평반고리관의 팽대부 대부분을 공급하고 뒤전정동맥은 후반고리관 팽대부와 구형낭의 대부분에 혈액을 공급하며 이는 각각 상전정신경과 하전정신경의 지배 분포와 일치한다[1]. 전정신경염은 주로 상전정신경을 침범하므로 대개 검사 결과 전반고리관, 수평반고리관 및 난형낭의 기능 저하를 보이게 된다.
전정신경염의 원인으로는 내이의 허혈 및 바이러스의 재활성화, 자가면역반응 등의 가설이 제기되고 있다. 다양한 바이러스의 항체 역가의 증가가 확인되기도 하였고[8], 부검증례에서 단순포진바이러스의 재활성화를 시사하는 결과를 보여 바이러스 감염과 관련된 병인이 주로 받아들여지고 있으나[14], 지혈작용과 관련된 다양한 혈액의 인자농도가 급성일측전정병증에서 변화하는 등 내이 허혈 또한 어느 정도 영향이 있을 것으로 추정된다[15]. 전정신경염을 비롯하여 어지럼증이 심혈관계위험인자와 연광성이 있다는 보고는 많다. 전정신경염 환자는 정상인에 비해 고혈압과 당뇨 등의 대사증후군 관련 인자가 더 높은 빈도로 관찰되었고[6], 고립성전정증후군 환자들은 뇌영상검사에서 백질변성의 정도가 더 심하게 확인되었으며[16] 이러한 환자들을 수년간 추적한 결과 대조군에 비해 뇌경색이 발병할 확률이 약 3배 가량 높고, 특히 뇌경색 관련 위험 인자가 3가지 이상 동반된 경우 5배 이상 더 높게 관찰되었다.
전정신경염의 발생에 있어 허혈성 원인이 일부 기여한다는 기존 연구결과를 고려하였을 때, 보다 심한 허혈을 동반할 수록 일부 분지보다 전체 전정신경에 영향을 끼칠 수 있어 비교적 완전 전정신경염에서 위험인자의 빈도가 높을 것이라 가정하였으나, 본 연구 결과분지성전정신경염 중 특히 상전정신경염 환자에서 조사된 혈관성 위험인자의 동반 빈도는 완전 전정신경염과 차이를 보이지 않았다. 즉, 허혈성 원인이 전정신경염 발생에 기여한다고 가정할 때, 보다 심한 내이 허혈의 가능성이 있다고 하여 일부분지보다 전체 전정신경이 이환될 확률이 더 높다고 보기 어렵다. 통계적으로 유의하지 않았으나 혈관성 위험인자는 오히려 상전정신경염에서 더 높은 빈도로 나타났고, 입원 당시 측정한 총콜레스테롤은 상전정신경염에서 완전전정신경염 보다 더 높게 관찰되었다. 이러한 결과는 전정신경 및 혈관 주행을 고려하였을 때 내이 허혈으로 인한 전정신경염 발생 시 상전정신경영역의 기능 저하가 더 쉽게 나타나기 때문일 수 있다[5]. 전정신경 상하분지의 구조차이를 보면, 상전정신경이 주행하는 통로가 단신경(singular nerve)에 비해 7배 가량 길고, 하전정신경의 주행 통로에 비해 더 좁고 많은 골침(bony spicules)이 존재하여 보다 허혈 및 신경 포착(nerve entrapment)에 취약하다고 알려져 있다. 이에 신경의 염증 및 부종이 일어나게 되면 통로가 더 좁고 표면이 매끈하지 못할 때 신경 포착이 더 쉽게 일어날 수 있다[17,18]. 또한 단신경과 상전정신경 각각의 세동맥 통로(arteriolar canal)에 대한 세동맥(arteriole)의 폭(width)을 비교하였을 때, 상전정신경이 단신경에 비해 세동맥 통로에 비해 세동맥 단면 폭이 차지하는 비율이 유의하게 높아 신경뿐만 아니라 혈관도 더 좁은 통로를 주행하고 있음을 알 수 있다[17].
전정신경염에서 부신피질호르몬제와 혈관확장제, 바이러스 감염에 대한 치료 등이 다양하게 시도되어 왔으며, 부신피질호르몬제가 온도안진검사로 측정된 반고리관마의 회복에 도움이 되지만 환자가 실제로 느끼는 증상의 호전에는 뚜렷한 영향이 없었으며 항바이러스제는 위약과 비교하였을 때 치료 효과가 없었다[19,20]. 혈관 허혈을 고려하여 혈관확장제가 경험적으로 사용되나 그 효과가 입증되지는 않았다[21]. 추후 연구를 통해 상전정신경을 침범하는 경우에 특히 허혈성 원인이 기여하는지에 대한 여부가 더 명확해 진다면, 추후 전정신경염의 각 분지별 이환분류에 따라 내이 허혈과 관련된 병인을 고려한 치료 방법을 선택하는 데 도움이 될 수 있겠다. 본 연구는 후향적분석, 단면연구라는 점에서 제한점이 있으며, 대상자가 입원치료를 하였던 전정신경염 환자들로 이로 인한 선택 편의(selection bias)가 작용하여 비교적 증상이 심하거나 위험인자가 많이 동반된 사람들이 포함되어 과하게 평가되었을 가능성이 있다. 또한 뇌영상검사가 모든 환자에서 실시되지 않아 백질변성이나 뇌혈관 협착 유무 등을 확인할 수 없어 내이 허혈과 관련된 간접적 요인인 심뇌혈관위험인자의 측정에 그쳤다. 또한 전정신경염 발생 당시의 실제혈류량을 측정한 것이 아니므로 내이 허혈에 관련된 요소를 위험인자 동반 여부로 판단하기에 한계가 있었을 것으로 추정된다. 이러한 한계점은 single photon emission computed tomography 등 기능영상이나 뇌혈류초음파 등을 이용하여 질병의 급성기에 동반된 뒤순환영역의 허혈을 계측화하여 추가 연구를 시행하여 보완할 수 있을 것이다.
완전 전정신경염과 분지성전정신경염 중 상전정신경염 환자에게서, 심혈관계위험인자의 동반 빈도에 따른 유의한 차이는 관찰되지 않았다. 단, 전정신경염으로 입원 당시 측정하였던 총콜레스테롤은 상전정신경염에서 완전 전정신경염군 보다 높게 확인되었다. 추후 제한점을 고려하여, 전정신경염의 침범 분지와 내이 허혈과의 연관성을 고려한 뇌영상연구 및 더 나아가 환자의 증상 회복에 있어 심혈관계위험인자 및 허혈과 관련된 요인의 역할을 규명하는 추적 연구가 필요할 것으로 보인다.
Notes
No potential conflict of interest relevant to this article was reported.
Acknowledgements
This work was supported by the Soonchunhyang University Research Fund.