전정신경초종의 진단과 치료: 어지럼 초점
Diagnosis and Management of Vestibular Schwannoma: Focus on Dizziness
Article information
Trans Abstract
Vestibular schwannoma (VS) is commonly encountered in the cerebellopontine angle and benign neoplasms that arise from Schwann cells of the eighth cranial nerve, which can show not only hearing loss but also various vestibular symptoms. Dizziness is the symptom causing significantly negative effect on quality of life in patients with VS. Here, we will review the dizziness in VS.
서론
전정신경초종은 소뇌교각(cerebellopontine angle)에서 가장 흔하게 발생하는 양성 종양으로 두개내 종양의 약 5%–10% 정도를 차지한다. 대부분 제8 뇌신경의 수초를 구성하는 슈반세포(schwann cell)에서 기원하여 서서히 성장하므로 초기에는 증상이 없을 수 있으나, 종물이 점점 커지면서 인접한 소뇌, 연수 및 제5, 7 뇌신경 또는 혈관을 압박하면서 증상이 발생하게 된다[1]. 흔한 증상으로는 일측성 청력감소 및 이명과 어지럼증이 있으나, 동반 증상이 다양해서 미로염이나 메니에르병 등의 감별 진단이 필요하다[2,3]. 그 중 어지럼증은 전정신경초종 환자의 삶의 질에 다른 어떤 증상보다 악영향을 끼치는 것으로 보고되고 있다[4,5].
전정신경초종 환자 중 전정기능장애는 약 40%–50%에서 발생하며[6,7], 최대 60%–75%까지 전정장애가 발생한다고 한다[8]. 그러나, 전정신경초종 환자의 현훈(vertigo) 의 실제 발생률은 알려져 있지 않은데, 이는 전정장애에 대한 임상적 초점이 부족하며 어지럼을 특징짓는 적절한 설문지나 선별검사가 없고, 특정한 현훈보다는 일반적인 전정증상에 초점을 맞추는 경우가 많기 때문이다[9]. 현훈을 구체적으로 보고한 연구에서는 전정신경초종 환자의 10%–15%에서 현훈이 발생했다고 보고하고 있다[7,10]. 전정신경초종 환자의 10% 정도가 진단 당시 청력이 정상에서 경한 난청인 것을 감안할 때, 현훈과 최소 청력소실이 있는 환자들 중 치료를 받지 못하고 간과 되는 경우가 있을 수 있다[8].
전정신경초종의 치료에는 경과 관찰(wait and scan), 미세수술적 절제와 정위적 방사선 수술(stereotactic radiosurgery) 이 있다. 치료법에 대한 연구에서는 대부분 청력보존 및 안면신경기능보존과 신경학적 이환율을 비교하는데 중점을 두고 있다.
최근 자기공명영상이 발달하고 건강보험 적용 범위가 확대됨에 따라 전정신경초종의 발생률은 점점 증가하고 있으며, 최근에는 매년 100만 명당 20명 정도로 알려져 있다[11]. 이에 본고에서는 전정신경초종의 어지럼 중심 으로 진단과 치료에 관해 고찰하고자 한다.
본론
1. 진단
오랜 기간 동안 지속적으로 악화되는 일측성 청력감소, 이명, 자세 불균형과 어지럼이 동반되는지를 문진을 통해 확인하는 것이 중요하다. 그러나, 전정신경초종 환자의 12%–26%에서는 돌발성 난청으로도 나타날 수 있다 [12,13]. 어음검사를 통해 어음 분별력이 현저히 감소된 일측 감각신경성 난청을 확인할 수 있으며, 청성뇌간반응검사를 통해 후미로 병변을 의심할 수 있다. 이 신경학적 검사에서 의심스러운 소견이 있을 경우 전정기능검사를 시행하겠지만, 전정신경초종의 명확한 진단방법은 가장 민감도가 높은 조영증강 자기공명영상이다.
1) 말초성 어지럼증과 중추성 어지럼증
(1) 말초성 어지럼증
전정신경초종의 어지럼 증상은 대개 경미한데, 이는 전정기능의 손상이 서서히 진행되어 중추 전정보상을 통해 이러한 전정기능 저하를 쉽게 극복할 수 있기 때문이다. 자발안진은 말초성 또는 중추성 장애로 인해 안구운동신경핵에 도달하는 긴장 신호의 부조화로부터 생기는 것으로, 전정신경초종의 자발안진은 일측 전정기능 장애로 인해 종양의 반대측으로 향하는 안진이 발생한다. 그러나 전정신경초종에서 자발안진이 드문 이유는 초기에 발생된 자발안진이 시간이 지남에 따라 보상작용으로 소실되기 때문이다.
전정신경초종 환자에서도 메니에르와 같은 반복성 현훈, 전정신경염이나 미로염과 같은 급성 현훈으로 발생할 수 있다. 이는 종양이 발생하면서 전정신경이 압박되거나 허혈성 손상을 일으켜 생길 수 있으며, 보상작용이 진행되면서 증상이 호전되지만 드물게 시간이 지나도 어지럼이 지속되는 경우도 있다[10].
전정신경초종 환자에서 나타나는 마비성 안진은 두위 변화 시 양성돌발두위현훈에 부합하는 안진이 관찰될 수 있다. 두위 변화에 따른 어지럼증의 유발과 안진의 발생 기전은, 첫 번째로는 종양의 성장에 의해 myelin막이 손상되어 axon이 노출된 곳이 두위 변화에 따라 당겨지거나 주변 조직과 겹치거나 눌리게 되어 발생하는 비정상적인 전도이다. 두 번째로는 하전정신경의 구심성 섬유의 부분 소실로 인한 좌우측 불균형으로 하방안진이 나타난 것이 거나, 종양이 매우 큰 경우라면 두위 변화에 따라 종양이 직접 소뇌의 전정신경핵을 압박하여 생기는 효과로 설명하고 있다[14].
회전성 어지럼은 흔하지 않으나 전정신경초종 환자의 7% 정도에서 나타난다고 알려져 있으며 주로 작은 종양에서 흔하고 종양의 크기가 커질수록 감소한다. 회전성 어지럼은 종양 발생 초기에 전정신경이 눌리거나 허혈성 손상을 받아 발생한다. 종양의 크기가 큰 경우 회전성 어지럼보다는 균형장애(disequilibrium), 또는 보행장애 등의 증상을 경험하며 약 반수의 환자에서 나타난다.
(2) 중추성 어지럼증
전정신경초종 환자에서는 양측 주시 때 각 주시 방향으로 향하는 안진이 발생할 수 있다. 병변 측을 바라볼때 병변 측을 향하는 느리고 큰(slow and large-amplitude) 주시유발안진(gaze evoked nystagmus)이 나타나며, 정상 측을 바라볼 때는 정상 측을 향하는 빠르고 작은 진폭(rapid and small amplitude)의 전정 안진(vestibular nystagmus)이 발생하는데, 이를 Bruns 안진이라 한다. 병변 측을 주시할때 발생하는 주시유발안진은 뇌간이나 소뇌 타래의 압박 으로 인한 속도저장 기전의 이상에 의해 발생하며, 정상측 주시에서 보이는 빠르고 작은 안진은 전정신경의 병변에 의한 전정비대칭에 의해 주로 발생한다. 전정신경초종 수술 후에도 같은 양상의 안진이 나타날 수 있다. 소뇌 교각 부위의 청신경종양에서 11%의 빈도를 보이며, 특히 종양 직경이 3.5 mm 이상일 경우에는 92% 안진이 발생하고, 67%에서 Bruns 안진이 관찰된다[15].
특징적으로, 전정신경초종 환자에서 과호흡에 의해 안진이 발생할 수 있다. 작은 크기의 종양에서는 과호흡에 의해 병변 측으로 향하는 안진이 발생할 수 있는데, 이는 종양으로 부분적 탈수초화(demyelination)된 전정신경이 과호흡에 의해 일시적으로 신경전도가 증가되어 병변 측으로 향하는 흥분성 안진이 발생한다고 한다[16]. 그래서, 어지럼을 주소로 내원한 환자에서 편 측의 청력소실과 전정신경병증이 있는 경우 병변 측으로 향하는 과호흡 유발 안진이 관찰된다면 뇌 자기공명영상 촬영을 시행해 전정 신경초종을 감별해야 한다. 크기가 큰 종양을 가진 환자에서는 과호흡에 의해 안진의 방향이 정상 쪽을 향하게 되는데, 이는 중추신경계 보상기전의 일시적 저하가 원인이다[16].
2) 전정기능검사
전정신경초종에서 전정기능검사는 종양을 감지하는데 높은 감도를 가지고 있지 않으며 결과는 일반적으로 비특이적이다. 그래서 종양을 진단하기보다 종양의 기원을 예상하고 보상 과정을 평가하며 술 후 발생될 수 있는 합병증을 대처하기 위한 평가로 주로 시행한다. 상전정신경을 검사하는 온도안진검사나 하전정신경을 검사하는 경부전정유발근전위검사가 있다. 온도안진검사를 통해 전정기능의 정도를 파악하지만, 최근에 비디오두부충동 검사로 각 반규관 전정기능의 정도를 평가하고, 상ㆍ하 전정신경의 침범 정도를 예측하여 술 후 어지럼의 정도를 예측할 수 있다(Fig. 1).
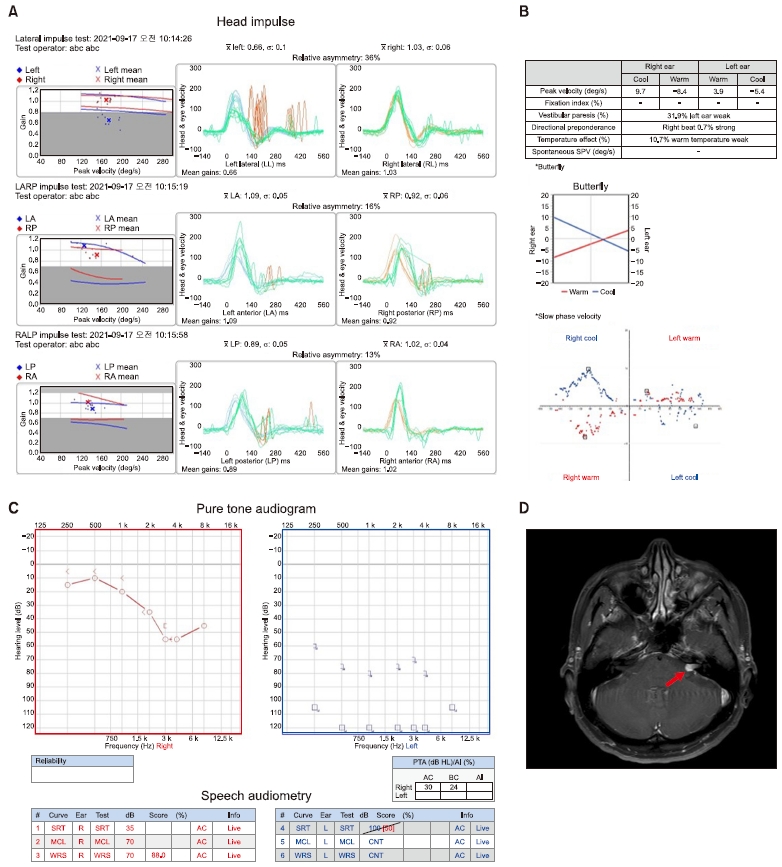
Left vestibular schwannoma superior vestibular nerve origin. (A) In video head impulse test: decreased gain and overt and covert saccade at left lateral semicircular canal. (B) In calory test: 31.9% canal paresis in left ear. (C) In pure-tone audiometry: profound sensorineural hearing loss in left side. (D) In enhanced brain magnetic resonance imaging: 12 mm sized enhanced mass in the left internal auditory canal (arrow). SRT, sppch reception threshold; MCL, most comfortable level of loudness; WRS, word recognition score.
수술 전 전정기능이 좋지 않은 환자는 수술 전 전정기능이 정상인 환자보다 더 빨리 회복된다. 실제로 비정상 전정기능은 주로 큰 종양에서 나타난다. Batuecas-Caletrio 등[17]은 전정신경초종 환자 50명 중 온도안진검사에서는 19명이 비정상을 보였고, 비디오두부충동검사에서는 45명이 비정상을 보여 전정안구반사 전정결손 진단은 비디오두부충동검사가 온도안진검사보다 우수하다고 보고하였다. 전정기능검사와 종양의 기원과 일치하는지에 대해 서는 보고자마다 이견이 있다.
3) 삶의 질 평가, Dizziness Handicap Inventory, Vertigo Symptom Scale, Vestibular Disorders Activities of Daily Living Scale
전정신경초종 환자의 삶의 질 평가는 Short Form 36 설문조사, Glasgow Benefit Inventory 및 Health Status Questionnaire를 포함한 도구가 있는데, 일반적인 건강 상태를 평가한다. 1990년 Jacobson과 Newman [18]이 개발한 Dizziness Handicap Inventory (DHI)는 일상 생활에서 어지러움의 인지된 영향을 다루고 장애 정도를 정량화하고 있다. 말초 현훈에 대해 개발된 또 다른 척도는 12개월 동안 현기증의 심각도와 빈도를 측정하는 Vertigo Symptom Scale (VSS)이다. VSS는 1990년대 초 Yardley와 동료들이 개발했으며 현훈의 심리적 요소를 강조하고 있다[19]. DHI가삶의 질과 장애 수준에 미치는 영향을 평가한다면, VSS는 22개의 질문으로 구성되어 있으며 현훈 발작의 빈도에 중점을 두고 평가한다.
DHI와 VSS의 단점을 보완한 현훈 척도인 Penn Acoustic Neuroma 삶의 질 척도[20]는 총 26개 문항, 7개의 영역으로 구성되어 있으며 전정신경초종 환자의 특성 증상과 연관된 삶의 질에 대해 평가할 수 있도록 구성되어 있다 [21].
한국어판 신의료기술로 어지럼이 일상생활 수행능력에 미치는 영향을 자세히 평가하는 설문인 전정질환 일상 생활 수행 척도(Vestibular Disorders Activities of Daily Living Scale)와 DHI가 임상적으로 사용되고 있다[22].
2. 치료
전정신경초종의 세 가지 치료방법으로 경과 관찰(wait and scan), 수술적 절제, 정위적 방사선 수술이 있다.
1) 경과 관찰
경과 관찰은 전정신경초종의 크기가 작은 경우 여러 치료방법 중에 좋은 방법일 수 있다. 특히 고령이거나 심각한 내과적 문제를 가지고 있으며 종양의 성장과 증상의 발현 기간보다 적은 여명을 가진 환자, 한쪽 청력만 있는 귀에 종양이 생겨 수술 후 전농의 가능성이 높은 환자에게는 좋은 전략일 수 있다. 이와 같은 치료방법은 환자의 증상을 주기적으로 평가하면서 추적 자기공명영상검사를 시행하여 종양 과정을 지속적으로 관찰하는 것이다. 일반적으로 종양의 성장률이 1년에 1–2 mm 정도지만, 1년에 25 mm 정도로 급격히 성장하는 경우도 있으며, 경과 관찰을 시행하였던 환자 중 74%에서 종양의 성장이나 청력 저하가 관찰되어 치료 실패로 판정한 보고도 있다[20].
전정신경초종 환자는 반복성 어지럼의 병력을 나타낼 수 있는데, 이 어지럼의 원인은 종양 자체로 인한 것일 수도 있지만, 전정편두통 혹은 양성돌발두위현훈이 동반될 수 있으므로 감별을 요한다[23].
전정신경초종 환자에서 경부전정유발근전위검사, 안구전정유발근전위검사와 비디오두부충동검사 중 3개 모두 비정상인 경우는 세 가지 말초 전정기관의 기능 부전을 의미하면서 종양의 크기가 컸고, 청력소실이 심했으며, DHI 점수도 상승하였다. 종양 크기와 청력손실 정도는 전정기능검사를 못하는 경우에는 잔여 전정기능을 예측하는 지표로 사용할 수 있다[24].
Choi 등[25]은 전정신경초종에 의한 재발성 현훈 환자 에서 항경련제인 oxcarbazepine 투여로 조절했다고 보고하였다. 이는 종양의 압박으로 인해 부분적으로 탈수초화된 전정신경으로부터의 신경분비물이 전정신경초종 환자의 현훈 발작의 병인일 수 있음을 시사하고 있다. Lee 등[26] 은 메니에르병 양상을 가진 전정신경초종 환자에서 고실 내 화학적 미로절제술을 통해 증상의 호전을 보였다고 보고하였다. 화학적 미로절제술은 외래 술기로 간단하게 시행할 수 있고 여러 번 반복적으로 시행할 수 있는 장점이 있지만, 청력을 약화시킬 수 있으므로 청력이 좋지 않은 환자에게 고려해야 한다고 권유하고 있다.
2) 수술적 절제
미세 수술적 절제의 목적은 종양을 완전히 제거하고 가능하면 청신경 및 인접 뇌신경들과 소뇌, 뇌간 손상을 피해 향후 합병증을 예방하는 데 있다. 수술적 치료방법으로 중두개와 접근법, 경미로 접근법, 후두하 접근법 등의 세 가지 접근법이 있다. 어떤 술식을 사용하느냐는 환자의 나이, 종양의 크기 및 위치, 술 전 청력이나 안면신경 상태, 환자가 바라는 기능보전의 종류 및 수술자의 숙련도와 선호도에 좌우된다. 수술 후 어지럼증과 재활에 있어서 소뇌의 역할이 매우 크므로, 어지럼 관점에서 수술은 경미로 접근법을 선호한다. 많은 문헌에서 경미로 접근법이 후두하 접근법보다 술 후 우수한 평형기능이 회복된다고 보고하고 있다[27].
전정신경초종이 수술로 절제되는 날은 갑자기 완전히 전정 구심로차단(vestibular deafferentation)이 발생하는 특별한 날이다. 수술 후 환자가 겪는 어지럼과 자세 불균형은 개인의 삶의 질에 심각한 손상을 입히므로 아주 중요한 문제이고, 오랫동안 지속되어 일상생활 활동이 제한될수 있다[28].
수술 전 전정계 잔여기능은 종양이 성장하면서 미치는 영향이 개인마다 다르므로 환자마다 상당히 차이가 나며, 수술 후 전정 증상도 다양하게 나타난다. 만약 수술 전에 상당한 전정기능이 남아 있는 상태에서 수술한다면, 급성 전정 구심로차단으로 인해 예외 없이 자발안진, 머리 및안구 기울기, 자세 불균형, 전정-안구 및 척추 반사 변형과 심한 오심 및 어지럼이 발생할 수 있다. 정적 보상은 시각 및 두부 회전과 관계없이 회복되며, 전정핵에서 나오는 이차 뉴런들 사이의 자발흥분도의 불일치를 감소시켜 오심ㆍ구토와 같은 증상들은 전정 구심로차단 후 첫 주 이내에 호전되지만, 정상적인 두부 회전에 의해 발생 하는 동적인 전정신호에는 여전히 적절히 반응할 수 없어 환자들은 회복이 안된 상태로 매우 심한 평형감각 장애를 호소하는데[29], 이는 동적 보상이 이루어질 때까지 계속된다.
전정보상 과정은 궁극적으로 중추성 전정장애 혹은 말초성 전정장애로 발생한 전정 부조화를 교정하기 위해 소뇌와 뇌간 핵에서 신경학적 변화를 통해 일어난다. 동적 보상은 정적 보상에 비해 더 느리며, 두부 회전에 따른 안구 움직임과 자세 조절 반응의 재조절이 필요하다. 이동적 보상이 전정초종수술 후 회복에 중요한 원리이다. 동적 보상은 크게 적응(adaptation), 습관화(habituation), 감각 대치(sensory substitution)로 나눌 수 있다. 전정 적응은 두부 회전으로 유발된 시야의 불안정을 안정시키기 위해 전정신경계통에서 나타나는 장기적인 적응 능력이다. 전정 습관화는 어지럼을 유발하는 자극을 반복하면 장기적으로 어지럼증이 감소하는 현상이다. 감각 대치는 손상된 전정기능을 대체하여 시각 혹은 체성 감각기능을 통해 시야 안정과 자세 유지에 도움을 주는 것이다.
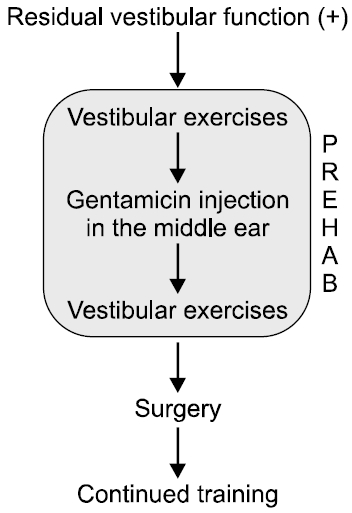
Tjernström 등[30]은 전정신경초종에서 겐타마이신을 이용한 화학적 미로절제술을 통해 수술 후 발생하는 어지럼을 줄일 수 있다고 보고하였다. 수술 전 전정기능검사를 통해 전정기능이 많이 남아있는 경우 3–4차례 화학적 미로절제술을 시행하고, 6–8주 정도 전정재활치료를 수술 전에 병행한 뒤 경미로 접근법에 의한 종양제거술을 시행 하였다. 겐타마이신으로 전처치한 환자는 술 후 자세 안정성이 유의하게 좋았고, 동적 상황에 접했을 때도 유의 하게 높은 적응능력을 보였다(Fig. 2). 이 전정 prehabilitation (PREHAB) 프로토콜은 고실 내 겐타마이신 주사 전후로 매일 전정운동을 수행하는 일정기간 동안 점진적으로 전정 구심로차단을 생성하여 전정 상이 뒤따를 수 있도록한 것이다.
수술 후 발생하는 어지럼을 최소화하기 위해서 수술중 소뇌로 가는 작은 혈관도 가능한 보존하고 소뇌를 과도하게 오래 견인하는 일은 피해야 한다. 예방적 니모디핀(nimodipine) 치료는 전정신경초종 수술 중에 청력과 안면신경 보존에 신경보호(neuroprotective) 역할을 함으로써 환자의 삶의 질을 향상시킬 수 있다고 보고하고 있다[31].
전정신경초종 수술 후 발생하는 오심과 어지럼 연구에서 여성이 남성보다 수술 후 유의하게 더 긴 기간 동안 항구토 약물치료가 필요했고, 종양 등급이 높은 3, 4등급인 경우는 오심과 어지럼에 대한 호소가 상대적으로 적었다. 즉, 작은 종양이 있는 여성에서 수술 후 오심과 어지럼의 증상이 많이 나타날 가능성이 높으므로 교육과 약물 처방이 필요하다[32].
3) 정위적 방사선 치료
방사선이 조사되어 종양조직에 주는 영향은 DNA 손상과 혈관 손상에 의한 혈관 폐색이라고 할 수 있으며 이는 혈관 기형의 치료기전에서 제시되고 있다. 이온화된 방사선이 조사되면 세포의 DNA에 손상을 가져와 세포 자멸사(apoptosis)가 일어나고 궁극적으로 종양세포를 퇴화시킨다. 그리고, 종양으로 가는 혈관에 작용된 방사선은 혈류를 차단시키고 이로 인해 서서히 종양세포의 허혈을 초래한다[33]. 종양의 억제율은 89%–98%, 청력의 보존은 12 Gy 이하를 조사받은 환자에서 50%–84%로 보고되고 있다. 최근 문헌에 의하면, 정위적 방사선 수술에서 상당한 양이 전정기관에 영향을 미치므로 5 Gy 이상의 조사량은 어지럼을 상당히 악화시키는 것으로 보고하였다[34]. 방사선 수술과 미세수술 모두 95%의 우수한 종양 조절률을 보고하고 있다[35,36]. 치료 후 청력소실 및 안면신경기능 감소로 인해 방사선 수술을 선호하는 치료법으로 권장하는 문헌 보고가 있지만[35], 전정신경초종 환자의 현훈을 분석한 장기간의 연구가 없기 때문에 심한 현훈이 있는 환자에게 방사선 수술의 이점이 있는지는 결정하기가 어려운 실정이다. 결론으로 전정신경초종의 치료에서 정위적 방사선 치료의 결과가 양호한 것으로 보고되고 있지만, 현재의 방사선 조사의 장기적인 결과는 잘 보고되어 있지 않으므로, 궁극적인 종양 억제율에 관한 결론에 도달하려면 장기적인 추적관찰이 필요하다.
결론
최근 자기공명영상의 발달로 인해 전정신경초종의 발생률은 점점 증가하고 있고, 어지럼의 증상은 전정신경초종 환자의 삶의 질에 악영향을 끼치고 있다. 치료 후 높은 청력 보존과 안면신경 보존도 중요하지만, 치료 전이나 치료 후에 발생하는 어지럼에 대한 많은 연구가 앞으로 필요할 것으로 여겨진다.
Notes
저자는 이 논문과 관련하여 이해관계의 충돌이 없음을 명시합니다.