Articles
- Page Path
- HOME > Res Vestib Sci > Volume 16(1); 2017 > Article
-
Review
메니에르병 병인기전의 전기생리학적 연구 - 김성헌
- Ménièreʼs Disease and Electrophysiology
- Sung Huhn Kim
-
Research in Vestibular Science 2017;16(1):1-9.
DOI: https://doi.org/10.21790/rvs.2017.16.1.1
Published online: March 15, 2017
Department of Otorhinolaryngology, Yonsei University College of Medicine, Seoul, Korea
- Corresponding Author: Sung Huhn Kim Department of Otorhinolaryngology, Yonsei University College of Medicine, 50 Yonsei-ro, Seodaemun-gu, Seoul 03722, Korea Tel: +82-2-2228-3604 Fax: +82-2-393-0580 E-mail: fledermaus@yuhs.ac
• Received: February 20, 2017 • Revised: February 22, 2017 • Accepted: February 22, 2017
Copyright © 2017 by The Korean Balance Society. All rights reserved.
This is an open access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/4.0) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
- 11,200 Views
- 175 Download
Abstract
- Inner ear is composed of cochlea, vestibule, and endolymphatic sac which are enclosed by thin layer of epithelial cells. The enclosed space is filled with fluid named as endolymph where the [K+] is high and [Na+] is low. This unique ion composition is very important in maintaining normal hearing and balance function by providing K+ ions into sensory hair cells, which finally depolarize hair cells to facilitate the transport of sound and acceleration stimulation to central nervous system. The ion composition of inner ear is maintained by various ion transport through ion channels, transporters, and exchangers in the inner ear sensory and extra-sensory epithelium. The disruption of normal endolymphatic ion composition by the deterioration of the function of those ion channels can cause dysfunction of sensory epithelium, which consequently results in hearing and balance disorders. One of the possible pathology from the disruption of inner ear ion homeostasis is endolymphatic hydrops which is a phenomenon of excessive fluid accumulation of inner ear. The dysfunction of ion channels in inner ear epithelium can be an etiology of Ménièreʼs disease since endolymphatic hydrops is a main pathological finding of the disease. In this review, we discussed about the possible pathological mechanism of Ménièreʼs disease as a perspective of channelopathy as well as the role of various ion channels in the regulation of inner ear fluid volume based on the findings revealed by electrophysiological studies.
서 론
본 론
1) 내이의 Na+ 이동과 내림프 부피 조절 간의 연관성
2) Cl– 이온의 이동과 내림프 부피 조절 간의 연관성
3) 기타 메니에르병과 연관된 이온채널 연구
결 론
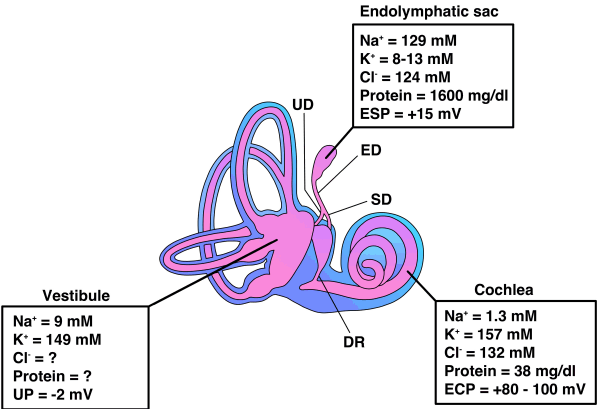
Figure 1.Anatomy of the inner ear and ion composition of endolymph. Endolymph which fills luminal space of membranous labyrnith has high [K+ ] and low [Na+], whereas perilymph which fills abluminal space of endolymph (perilymph) has high [Na+] and low [K+]. Endocochlear potential is higher than those in vestibule and endolymphatic sac, which expedites absorption of cation through mechanosensitive non-selective cation channel in the hair cells. ESP, endolymphatic sac potential; UP, utricular potential; ECP, endocochlear potential; UD, utricular duct; ED, endolymphatic duct; SD, saccular duct; DR, ductus reuniens [3].


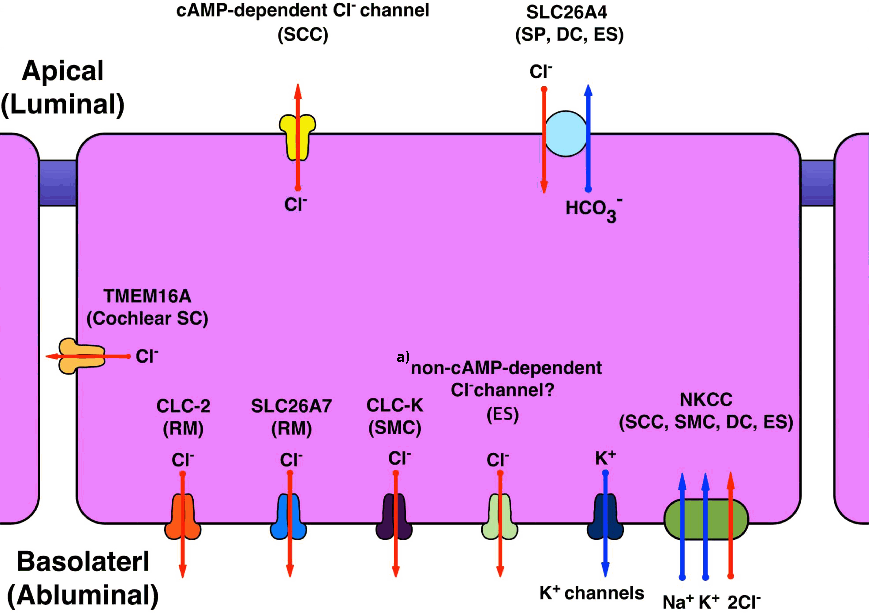
Figure 2.Ion channels, transporters, and exchangers involved in Na+ transport in the inner ear extra-sensory epithelial cells. ES, endolymphatic sac epithelium; NSC, non-selective cation channel; NHE, Na+ /H+ exchanger; ENaC, epithelial Na+ channel; RM, Reissner’s membrane; SCC, semicircular canal duct epithelium; S, saccular roof extra-sensory epithelium; P2XR, P2X receptors; SC, supporting cell; OSC, outer sulcus cell; TC, transitional cell; NKCC, Na+ –K+ –2Cl– cotransporter; SMC, strial margnial cell; DC, dark cell.


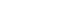
Figure 3.Ion channels, transporters, and exchangers involved in Cl– transport in the inner ear extra-sensory epithelial cells. SCC, semicircular canal duct epithelium; SC, supporting cell; RM, Reissner’s membrane; SMC, strial marginal cell; NKCC, Na+ –K+ –2Cl– cotransporter; SP, spiral prominence, root cell; DC, dark cell; ES, endolymphatic sac epithelium; SCC, semicircular canal duct epithelium. a)It is uncertain if non-cAMP dependent Cl– channel is located on apical or basolateral surface (or both). It is possible that it can be an anion exchanger.
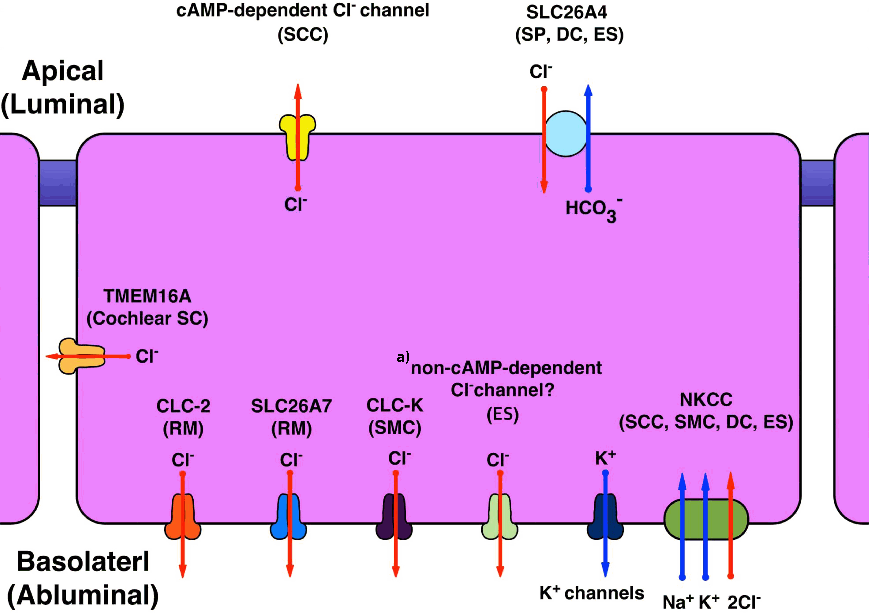

Table 1.Distribution and location of ion channels, transporters, exchangers involved in Na+ transport in the inner ear
| Ion channels, transporters, and exchangers | Distribution and location | References |
|---|---|---|
| Na+ absorption | ||
| Epithelial Na+ channel (ENaC) | Apical surfaces of Reissner’s membrane, semicircular canal duct epithelium, saccular roof extra-sensory epithelium, and endolymphatic sac epithelium | [9–12] |
| Amiloride-sensitive Na+ channel | Apical surfaces of endolymphatic sac epithelium | [7] |
| Stretch-activated ion channel | Apical surface of Reissner’s membrane | [14] |
| Na+/H+ exchanger | Apical or basolateral surface of endolymphatic sac epithelium | [13] |
| P2X receptor | Apical surfaces of cochlear outer sulcus cell, vestibular ampullary transitional cell, and cochlear and utricular supporting cell | [15–18] |
| Ca+ sensitive non-selective cation channel | Apical surface of endolymphatic sac epithelium | [8] |
| Na+-K+–2Cl– cotransporter | Basolateral surfaces of strial margical cell and basal cell, vestibular dark cell, and endolymphatic sac epithelium | [3], [18] |
| Na+ secretion | ||
| Na+/K+–ATPase | Basolateral surfaces of Reissner’s membrane, semicircular canal duct epithelium, saccular roof extra-sensory epithelium, strial marginal cell, vestibular dark cell, and endolymphatic sac epithelium | [3], [18] |
Table 2.Distribution and location of ion channels, transporters, exchangers involved in Cl– transport in the inner ear
| Ion channels, transporters, and exchangers | Distribution and location | References |
|---|---|---|
| Cl– secretion | ||
| CLC–2, SLC26A7 | Basolateral surface of Reissner’s membrane | [22], [23] |
| CLC-K | Basolateral surface of strial marginal cells | [21] |
| c-AM P-dependent Cl– Channel | Apical surface of semicircular duct epithelium | [24], [26] |
| Non-c-AMP-dependent Cl– Channel or anion exchanger | Apical or basolateral surface of endolymphatic sac epithelium | [31] |
| TMEM16A | Basolateral surface of cochlear supporting cell | [16] |
| Na+–K+-2Cl– cotransporter | Basolateral surfaces of strial margicnal cell, vestibular dark cell, and endolymphatic sac epithelium | [18] |
| Cl– absorption | ||
| SLC26A4 | Apical surfaces of spiral prominence epithelium, spiral root cell, vestibular dark cell, and endolymphatic sac epithelium | [25] |
- 1. Sajjadi H, Paparella MM. Ménièreʼs disease. Lancet 2008;372:406–14.ArticlePubMed
- 2. Salt AN. Regulation of endolymphatic fluid volume. Ann N Y Acad Sci 2001;942:306–12.ArticlePubMed
- 3. Kim SH, Kim BG, Kim JY, Roh KJ, Suh MJ, Jung J, et al. Electrogenic transport and K(+) ion channel expression by the human endolymphatic sac epithelium. Sci Rep 2015;5:18110. ArticlePubMedPMC
- 4. Fettiplace R, Kim KX. The physiology of mechanoelectrical transduction channels in hearing. Physiol Rev 2014;94:951–86.ArticlePubMedPMC
- 5. Gates P. Hypothesis: could Ménièreʼs disease be a channelopathy? Intern Med J 2005;35:488–9.ArticlePubMed
- 6. Zdebik AA, Wangemann P, Jentsch TJ. Potassium ion movement in the inner ear: insights from genetic disease and mouse models. Physiology (Bethesda) 2009;24:307–16.ArticlePubMedPMC
- 7. Mori N, Wu D. Low-amiloride-affinity Na+ channel in the epithelial cells isolated from the endolymphatic sac of guinea-pigs. Pflugers Arch 1996;433:58–64.ArticlePubMed
- 8. Miyashita T, Tatsumi H, Furuta H, Mori N, Sokabe M. Calcium-sensitive nonselective cation channel identified in the epithelial cells isolated from the endolymphatic sac of guinea pigs. J Membr Biol 2001;182:113–22.ArticlePubMed
- 9. Kim SH, Kim KX, Raveendran NN, Wu T, Pondugula SR, Marcus DC. Regulation of ENaC-mediated sodium transport by glucocorticoids in Reissner's membrane epithelium. Am J Physiol Cell Physiol 2009;296:C544–57.ArticlePubMedPMC
- 10. Pondugula SR, Sanneman JD, Wangemann P, Milhaud PG, Marcus D C. Glucocorticoids stimulate cation absorption by semicircular canal duct epithelium via epithelial sodium channel. Am J Physiol Renal Physiol 2004;286:F1127–35.ArticlePubMed
- 11. Kim SH, Marcus DC. Endolymphatic sodium homeostasis by extramacular epithelium of the saccule. J Neurosci 2009;29:15851–8.ArticlePubMedPMC
- 12. Kim SH, Park HY, Choi HS, Chung HP, Choi JY. Functional and molecular expression of epithelial sodium channels in cultured human endolymphatic sac epithelial cells. Otol Neurotol 2009;30:529–34.ArticlePubMed
- 13. Son EJ, Moon IS, Kim SH, Kim SJ, Choi JY. Interferon-gamma suppresses Na+ -H+ exchanger in cultured human endolymphatic sac epithelial cells. J Cell Biochem 2009;107:965–72.ArticlePubMed
- 14. Yeh TH, Herman P, Tsai MC, Tran Ba Huy P, Van den Abbeele T. A cationic nonselective stretch-activated channel in the Reissner's membrane of the guinea pig cochlea. Am J Physiol 1998;274:C566–76.ArticlePubMed
- 15. Lee JH, Chiba T, Marcus DC. P2X2 receptor mediates stimulation of parasensory cation absorption by cochlear outer sulcus cells and vestibular transitional cells. J Neurosci 2001;21:9168–74.ArticlePubMedPMC
- 16. Wang HC, Lin CC, Cheung R, Zhang-Hooks Y, Agarwal A, Ellis-Davies G, et al. Spontaneous Activity of Cochlear Hair Cells Triggered by Fluid Secretion Mechanism in Adjacent Support Cells. Cell 2015;163:1348–59.ArticlePubMedPMC
- 17. Kim E, Hyrc KL, Speck J, Salles FT, Lundberg YW, Goldberg MP, et al. Missense mutations in Otopetrin 1 affect subcellular localization and inhibition of purinergic signaling in vestibular supporting cells. Mol Cell Neurosci 2011;46:655–61.ArticlePubMedPMC
- 18. Kim SH, Marcus DC. Regulation of sodium transport in the inner ear. Hear Res 2011;280:21–9.ArticlePubMedPMC
- 19. Paparella MM, Djalilian HR. Etiology, pathophysiology of symptoms, and pathogenesis of Ménièreʼs disease. Otolaryngol Clin North Am 2002;35:529–45.ArticlePubMed
- 20. Fahlke C, Fischer M. Physiology and pathophysiology of ClC-K/barttin channels. Front Physiol 2010;1:155. ArticlePubMedPMC
- 21. Kim KX, Sanneman JD, Kim HM, Harbidge DG, Xu J, Soleimani M, et al. Slc26a7 chloride channel activity and localization in mouse Reissner’s membrane epithelium. PLoS One 2014;9:e97191.ArticlePubMedPMC
- 22. Kim KX, Marcus DC. Inward-rectifier chloride currents in Reissner’s membrane epithelial cells. Biochem Biophys Res Commun 2010;394:434–8.ArticlePubMedPMC
- 23. Pondugula SR, Kampalli SB, Wu T, De Lisle RC, Raveendran NN, Harbidge DG, et al. cAMP-stimulated Cl- secretion is increased by glucocorticoids and inhibited by bumetanide in semicircular canal duct epithelium. BMC Physiol 2013;13:6. ArticlePubMedPMC
- 24. Wangemann P. Mouse models for pendrin-associated loss of cochlear and vestibular function. Cell Physiol Biochem 2013;32:157–65.ArticlePubMedPMC
- 25. Milhaud PG, Pondugula SR, Lee JH, Herzog M, Lehouelleur J, Wangemann P, et al. Chloride secretion by semicircular canal duct epithelium is stimulated via beta 2-adrenergic receptors. Am J Physiol Cell Physiol 2002;283:C1752–60.ArticlePubMed
- 26. Park HJ, Lee SJ, Jin HS, Lee JO, Go SH, Jang HS, et al. Genetic basis of hearing loss associated with enlarged vestibular aqueducts in Koreans. Clin Genet 2005;67:160–5.ArticlePubMed
- 27. Kim HM, Wangemann P. Failure of fluid absorption in the endolymphatic sac initiates cochlear enlargement that leads to deafness in mice lacking pendrin expression. PLoS One 2010;5:e14041.ArticlePubMedPMC
- 28. Li X, Sanneman JD, Harbidge DG, Zhou F, Ito T, Nelson R, et al. SLC26A4 targeted to the endolymphatic sac rescues hearing and balance in Slc26a4 mutant mice. PLoS Genet 2013;9:e1003641.ArticlePubMedPMC
- 29. Bagger-Sjoback D, Friberg U, Rask-Anderson H. The human endolymphatic sac. An ultrastructural study. Arch Otolaryngol Head Neck Surg 1986;112:398–409.ArticlePubMed
- 30. Kim BG, Kim JY, Jung J, Moon IS, Yoon J-H, Choi JY, et al. β1- and β2-adrenergic stimulation-induced electrogenic transport by human endolymphatic sac epithelium and its clinical implications. Sci Rep 2017;7:42217. ArticlePubMedPMC
- 31. Martin-Sierra C, Requena T, Frejo L, Price SD, Gallego-Martinez A, Batuecas-Caletrio A, et al. A novel missense variant in PRKCB segregates low-frequency hearing loss in an autosomal dominant family with Meniere's disease. Hum Mol Genet 2016;25:3407–15.ArticlePubMedPMC
- 32. Salt AN, Plontke SK. Endolymphatic hydrops: pathophysiology and experimental models. Otolaryngol Clin North Am 2010;43:971–83.ArticlePubMedPMC
- 33. Hennings JC, Picard N, Huebner AK, Stauber T, Maier H, Brown D, et al. A mouse model for distal renal tubular acidosis reveals a previously unrecognized role of the V-ATPase a4 subunit in the proximal tubule. EMBO Mol Med 2012;4:1057–71.ArticlePubMedPMC
- 34. Lorente-Canovas B, Ingham N, Norgett EE, Golder ZJ, Karet Frankl FE, Steel KP. Mice deficient in H+-ATPase a4 subunit have severe hearing impairment associated with enlarged endolymphatic compartments within the inner ear. Dis Model Mech 2013;6:434–42.ArticlePubMed
- 35. Jung J, Seo YW, Choi JY, Kim SH. Vestibular function is associated with residual low-frequency hearing loss in patients with bi-allelic mutations in the SLC26A4 gene. Hear Res 2016;335:33–9.ArticlePubMed
REFERENCES
Figure & Data
References
Citations
Citations to this article as recorded by 


 KBS
KBS
 PubReader
PubReader ePub Link
ePub Link Cite
Cite